Elektron Dizilimi Özellikleri Ve Faydaları Nelerdir?
Elektron dizilimi, atomların elektronlarının enerji seviyelerine ve orbitallerine göre düzenlenmesini ifade eder. Bu yapı, atomların kimyasal özelliklerini belirlemede kritik bir rol oynar. Elektron dizilimleri, atomların tepkime verimliliğini, bağlanma özelliklerini ve genel davranışlarını etkileyen temel bir unsurdur.
Elektron Diziliminin Temel Özellikleri
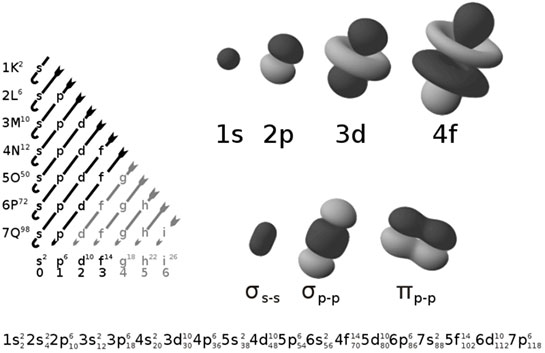
Elektron dizilimlerinin bazı temel özellikleri şunlardır: - Enerji Seviyeleri: Elektronlar, belirli enerji seviyelerinde bulunurlar ve bu seviyeler, atomun çekirdek etrafında yer alan orbitallerde düzenlenmiştir.
- Pauli Dışlama İlkesi: Aynı enerji seviyesindeki bir orbitalde iki elektron bulunamaz. Bu, elektronların diziliminde önemli bir kuraldır.
- Hund Kuralı: Eş enerjili orbitallerde elektronlar, mümkün olan en fazla sayıda tekli elektron ile doldurulmalıdır. Bu, atomların daha stabil bir yapıya ulaşmasını sağlar.
- Valans Elektronları: Atomun dış katmanındaki elektronlar, kimyasal bağların oluşumunda kritik bir rol oynar. Valans elektronları, atomların reaktifliğini belirler.
Elektron Diziliminin Faydaları
Elektron diziliminin birçok faydası bulunmaktadır: - Kimyasal Davranış: Elektron dizilimi, atomların kimyasal tepkimelerde nasıl davranacağını belirler. Örneğin, benzer dizilime sahip elementler benzer kimyasal özellikler gösterir.
- Moleküler Yapılar: Moleküllerin yapısı ve stabilitesi, atomların elektron dizilimleri ile doğrudan ilişkilidir. Bu, moleküler kimya ve biyokimya alanlarında önemlidir.
- Elektriksel Özellikler: Elektron dizilimi, malzemelerin elektriksel iletkenliğini etkiler. Metalik bağlar ve yarı iletken özellikler, elektronların dizilimi ile belirlenir.
- İleri Teknoloji: Kuantum bilgisayarlar ve diğer gelişmiş teknolojiler, atomların elektron dizilimleri ile ilgili bilgileri kullanarak çalışmaktadır. Bu da enerji verimliliği ve bilgi işlem gücünün artırılmasına yardımcı olur.
Sonuç
Elektron dizilimi, atomların kimyasal ve fiziksel özelliklerini anlamak için kritik bir kavramdır. Elektronların enerji seviyelerine ve orbitallerine göre düzenlenmesi, malzemelerin davranışını etkileyen temel bir unsur olup, bilim ve teknolojide birçok alanda uygulama bulmaktadır. Bu nedenle, elektron diziliminin incelenmesi, hem temel bilimler hem de mühendislik alanlarında büyük bir öneme sahiptir.
Ekstra Bilgiler
- Dizilimlerin Notasyonu: Elektron dizilimleri, belirli bir formatta gösterilir; örneğin, 1s² 2s² 2p⁶ gibi. Bu, elektronların hangi orbitallerde bulunduğunu gösterir.- Dört Temel Kuantum Sayısı: Elektronların diziliminde, her bir elektron için dört kuantum sayısı kullanılır: ana kuantum sayısı (n), açısal momentum kuantum sayısı (l), manyetik kuantum sayısı (m) ve spin kuantum sayısı (s).- Periyodik Tablo ile İlişki: Elektron dizilimleri, periyodik tablodaki elementlerin düzenlenmesinde de önemli bir rol oynar. Elementlerin yan yana gelmesi, benzer dizilim özelliklerinden kaynaklanır.
|
.webp)








.webp)
.webp)









.webp)


.webp)
.webp)

.webp)
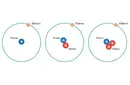










Elektron dizilimi neden atomların kimyasal özelliklerini bu kadar etkiliyor? Bir atomun kararlı hale gelmesi için mutlaka oktet veya dublet kuralına mı uyması gerekiyor? Dublet ve oktet kuralına uyan elementler dışında kararlı atomlar var mı?
Lebabe,
Elektron Diziliminin Önemi: Elektron dizilimi, atomun enerji seviyelerindeki elektronların nasıl dağıldığını gösterir ve bu da atomun kimyasal reaktivitesini belirler. Atomların diğer atomlarla nasıl etkileşime gireceğini ve hangi tür bağlar oluşturacağını etkiler.
Oktet ve Dublet Kuralları: Oktet kuralı, bir atomun dış enerji seviyesinde sekiz elektron bulundurma eğiliminde olduğunu belirtir. Bu durum, atomun daha kararlı olmasını sağlar. Dublet kuralı ise, özellikle hidrojen ve helyum gibi daha küçük atomlar için geçerlidir ve bu atomların dış enerji seviyelerinde iki elektron bulundurmasını öngörür.
Diğer Kararlı Atomlar: Oktet veya dublet kuralına uymayan ve yine de kararlı olan atomlar vardır. Geçiş metalleri ve iç geçiş metalleri bu duruma örnektir. Bu elementler, d ve f orbitallerindeki elektron dizilimleri sayesinde farklı kararlılıklar gösterebilirler.
Umarım bu bilgiler sorularınıza yanıt olabilmiştir.
Sevgiler,