Kimya Asit Baz Özellikleri ve Faydaları Nelerdir?
Asitler ve bazlar, kimyanın temel bileşenleridir ve birçok alanda önemli rollere sahiptir. Bu yazıda, asit ve bazların özellikleri, sınıflandırmaları ve çeşitli kullanım alanları üzerinde durulacaktır. Ayrıca, bu bileşenlerin sağladığı faydalar ve kimyasal süreçlerdeki etkileri de ele alınacaktır.
Kimya, maddelerin yapısını, özelliklerini, bileşimlerini ve değişimlerini inceleyen bir bilim dalıdır. Bu bilim dalının önemli bir alanı, asitler ve bazlar olarak bilinen iki temel kimyasal bileşendir. Asitler ve bazlar, birçok kimyasal reaksiyonun temel bileşenleridir ve çeşitli endüstriyel, tarımsal ve biyolojik süreçlerde önemli roller üstlenirler. Bu makalede asit ve bazların özellikleri, sınıflandırmaları ve kullanım alanları detaylı bir şekilde ele alınacaktır. Asitlerin Özellikleri Asitler, hidrojen iyonu (H+) salabilen maddelerdir. Genellikle ekşi bir tat, aşındırıcı özellikler ve su ile karıştıklarında iyonlaşma eğilimleri ile tanınırlar. Asitlerin bazı temel özellikleri şunlardır:
Bazların Özellikleri Bazlar, hidrojen iyonu (H+) alabilen veya hidroksit iyonu (OH-) verebilen maddelerdir. Genellikle acı bir tat, kaygan bir his ve su ile karıştıklarında çözünme eğilimleri ile tanınırlar. Bazların bazı temel özellikleri şunlardır:
Bazlar da güçlü ve zayıf olmak üzere iki gruba ayrılır. Güçlü bazlar, su içinde tamamen iyonlaşan maddelerdir; örneğin, sodyum hidroksit (NaOH) ve potasyum hidroksit (KOH). Zayıf bazlar ise kısmen iyonlaşan bileşenlerdir; örneğin, amonyak (NH3) ve sodyum bikarbonat (NaHCO3). Asit-Baz Teorileri Asit ve bazların tanımlanması için birkaç farklı teori geliştirilmiştir. Bunlar arasında en yaygın olanları şunlardır:
Bu teoriler, asit ve bazların kimyasal davranışlarını anlamada yardımcı olur ve birçok kimyasal süreçte önemli bir yere sahiptir. Asit ve Bazların Faydaları Asitler ve bazlar, endüstriyel, tarımsal ve biyolojik alanlarda birçok fayda sağlar. Bunlar arasında:
Sonuç Asitler ve bazlar, kimyanın temel bileşenleridir ve birçok alanda önemli işlevler üstlenir. Bu bileşenlerin doğru bir şekilde anlaşılması, hem bilimsel çalışmalarda hem de günlük hayatta yaşanan birçok olgunun daha iyi kavranmasına yardımcı olur. Kimya eğitimi sırasında asit ve bazların özelliklerinin öğrenilmesi, öğrencilerin kimyasal reaksiyonları anlamalarına ve uygulamalarını gerçekleştirmelerine olanak tanır. Bu bağlamda, asit ve bazların özellikleri ve faydaları üzerine yapılan araştırmalar, bilimsel gelişmelerin yanı sıra günlük yaşamda da önemli katkılar sağlayacaktır. |

.webp)








.webp)
.webp)









.webp)


.webp)
.webp)

.webp)










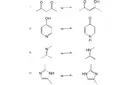
Bu metindeki bilgileri öğrendiğimde neden HCl ve H2SO4 gibi asitlerin kuvvetli olduğunu, HF ve CH3COOH gibi asitlerin ise zayıf olarak kabul edildiğini daha iyi anlayabiliyor muyum? Ayrıca, neden turnusol kağıdı asitlerde kırmızıya, bazlarda maviye dönüşüyor?
Öncelikle, Belinda hanım, kimyasal asitlerin kuvvetli veya zayıf olma durumlarını daha iyi anlamak için asitlerin iyonlaşma derecelerine bakmak gerekir. HCl ve H₂SO₄ gibi kuvvetli asitler, suda tamamen iyonlaşarak H⁺ iyonlarını serbest bırakırlar. Bu nedenle, çözeltide yüksek oranda H⁺ iyonu bulunur ve bu da onların kuvvetli asit olarak sınıflandırılmalarına neden olur. Diğer yandan, HF ve CH₃COOH gibi zayıf asitler ise suda kısmen iyonlaşır, yani çözeltide daha az H⁺ iyonu bulunur. Bu da onların zayıf asit olarak kabul edilmelerine yol açar.
Turnusol kağıdının asitlerde kırmızıya, bazlarda maviye dönüşmesi ise pH değerine bağlı bir renk değişimidir. Turnusol kağıdı, pH seviyesine duyarlı doğal bir boya maddesidir. Asidik ortamlarda (pH<7) kırmızı renge dönüşürken, bazik ortamlarda (pH>7) mavi renge dönüşür. Bu renk değişimi, turnusol kağıdındaki moleküllerin farklı pH seviyelerinde farklı şekillerde protonlanması veya deprotonlanması ile oluşur.