Redoks Özellikleri ve Faydaları Nelerdir?
Redoks reaksiyonları, elektron transferine dayalı kimyasal süreçler olup, birçok biyolojik ve endüstriyel sistemin temelini oluşturur. Oksidasyon ve redüksiyon süreçleriyle enerji üretimi ve çevresel temizlik gibi alanlarda önemli faydalar sağlar. Bu makalede redoks özellikleri ve uygulama alanları incelenecektir.
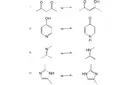
Redoks (redüksiyon-oksidasyon) reaksiyonları, elektron transferine dayalı kimyasal süreçlerdir ve birçok biyolojik ve kimyasal sistemin temelini oluştururlar. Bu makalede redoks özellikleri, mekanizmaları ve faydaları ele alınacaktır. Redoks Reaksiyonlarının Temel İlkeleri Redoks reaksiyonları, iki ana süreçten oluşur: oksidasyon ve redüksiyon. Oksidasyon, bir atomun veya molekülün elektron kaybetmesi anlamına gelirken, redüksiyon, bir atomun veya molekülün elektron kazanmasıdır. Bu süreçler birbirleriyle sıkı bir ilişki içindedir ve genellikle birlikte gerçekleşirler.
Redoks reaksiyonları, farklı enerji seviyeleri arasında elektron transferini sağlar ve enerji üretiminde önemli bir rol oynar. Redoks Reaksiyonlarının Özellikleri Redoks reaksiyonlarının bazı temel özellikleri şunlardır:
Redoks Reaksiyonlarının Kullanım Alanları Redoks reaksiyonları, birçok endüstriyel ve biyolojik süreçte kritik bir öneme sahiptir. Bunlardan bazıları şunlardır:
Redoks Reaksiyonlarının Faydaları Redoks reaksiyonlarının sağladığı bazı önemli faydalar şunlardır:
Sonuç Redoks reaksiyonları, hem kimyasal hem de biyolojik sistemlerde merkezi bir rol oynar ve enerji üretiminden çevresel korumaya kadar geniş bir uygulama yelpazesine sahiptir. Bu reaksiyonların anlaşılması, bilim ve mühendislik alanlarındaki birçok yeniliğin temelini oluşturmakta ve gelecekteki araştırmalara yön vermektedir. Redoks süreçlerinin derinlemesine incelenmesi, özellikle sürdürülebilir enerji kaynakları ve çevre dostu teknolojiler geliştirme çabalarında büyük bir potansiyele sahiptir. |

.webp)








.webp)
.webp)









.webp)


.webp)
.webp)

.webp)










Redoks reaksiyonlarının temellerini anlamakta zorlanıyorum, elektro pozitiflik ve elektro negatiflik değerlerini nasıl belirleyebilirim? Ayrıca, yükseltgen ve indirgen maddelerin güçlerini sınıflandırırken nelere dikkat etmeliyim? Bu konuda daha fazla bilgi verebilir misiniz?
Muammer Bey,
Redoks reaksiyonlarını anlamakta zorlandığınızı belirtmişsiniz. Bu konuda size yardımcı olabilirim. İşte temel bilgiler:
Elektro pozitiflik ve elektro negatiflik değerleri:
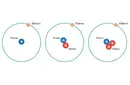
- Elektro Pozitiflik: Bir elementin elektron verme eğilimidir. Genelde metal elementlerde yüksek olur. Periyodik tabloda sola ve aşağıya gittikçe artar.
- Elektro Negatiflik: Bir elementin elektron alma eğilimidir. Genelde ametal elementlerde yüksek olur. Periyodik tabloda sağa ve yukarıya gittikçe artar. Pauling elektro negatiflik ölçeğini kullanarak belirleyebilirsiniz.
Yükseltgen ve indirgen maddelerin güçleri:
- Yükseltgen Madde: Elektron alarak indirgenen maddelerdir. Yükseltgenme potansiyeli yüksek olan maddeler daha güçlü yükseltgendir.
- İndirgen Madde: Elektron vererek yükseltgenen maddelerdir. İndirgenme potansiyeli yüksek olan maddeler daha güçlü indirgendir.
Dikkat Edilmesi Gerekenler:
- Elektron alışverişinin hangi yönde olduğuna dikkat edin.
- Redoks çiftlerinin standart elektrot potansiyellerini kontrol edin.
- Periyodik tablodaki konumlarına bakarak maddelerin elektro pozitiflik ve elektro negatiflik eğilimlerini tahmin edebilirsiniz.
Umarım bu bilgiler işinize yarar. Daha fazla yardıma ihtiyacınız olursa lütfen sormaktan çekinmeyin.
Sevgiler,
Muammer Bey