Kimyasal Bağlar Nelerdir?
Kimyasal bağlar, atomlar arasındaki etkileşimleri tanımlar ve maddelerin fiziksel ile kimyasal özelliklerini belirler. İyonik, kovalent ve metal bağlar gibi farklı türleri, moleküllerin yapısını ve işlevselliğini etkiler. Bu bağların anlaşılması, kimya ve ilgili bilimler için hayati öneme sahiptir.
Kimyasal bağlar, atomlar arasında meydana gelen etkileşimlerdir ve bu etkileşimler, maddelerin fiziksel ve kimyasal özelliklerini belirler. Kimyasal bağların temel amacı, atomların daha kararlı bir yapı oluşturmasını sağlamaktır. Bu bağlar, çeşitli türlerde sınıflandırılabilir ve her biri farklı özellikler taşır. Kimyasal Bağ Türleri Kimyasal bağlar genel olarak üç ana gruba ayrılmaktadır:
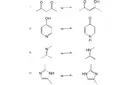
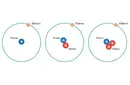
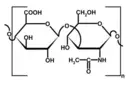
İyonik Bağlar İyonik bağlar, bir atomun elektron kaybetmesi ve diğer bir atomun bu elektronu kazanması sonucu oluşur. Bu süreç, pozitif yüklü katyon ve negatif yüklü anyonların oluşturulmasına yol açar. İyonik bağlar genellikle metal ve ametal atomları arasında gerçekleşir. Örneğin, sodyum klorür (NaCl) tuzu, sodyum ve klor atomları arasında bir iyonik bağın oluşumunun tipik bir örneğidir. Kovalent Bağlar Kovalent bağlar, iki atomun ortak bir veya daha fazla elektron çifti paylaşmasıyla oluşur. Bu bağ, genellikle ametal atomları arasında meydana gelir. Kovalent bağlar, tek, çift veya üçlü bağlar şeklinde sınıflandırılabilir. Örneğin, su (H2O) molekülündeki hidrojen ve oksijen atomları arasındaki bağlar kovalent bağlardır. Metal Bağlar Metal bağlar, metal atomlarının elektronlarını ortaklaşa kullandığı bir bağ türüdür. Bu bağ, metal atomlarının serbest elektronlar (deniz modeli) oluşturması ile karakterizedir. Bu serbest elektronlar, metallerin elektriksel iletkenlik, ısı iletkenliği ve şekil verilebilirlik gibi özelliklerini sağlar. Kimyasal Bağların Özellikleri Kimyasal bağlar, çeşitli fiziksel ve kimyasal özelliklere sahiptir. Bu özellikler bağın türüne bağlı olarak değişir:
Kimyasal Bağların Önemi Kimyasal bağlar, doğadaki tüm maddelerin oluşumunda ve varlığında kritik bir rol oynamaktadır. Bu bağlar, moleküllerin yapısını belirler ve kimyasal reaksiyonların gerçekleşmesini sağlar. Aynı zamanda, biyolojik sistemlerde de önemli bir yer tutar; örneğin, DNA ve proteinlerin yapısında kimyasal bağlar bulunur. Sonuç Kimyasal bağlar, atomlar arasındaki etkileşimlerin temelini oluşturarak maddelerin özelliklerini şekillendirir. İyonik, kovalent ve metal bağlar, maddelerin fiziksel ve kimyasal özelliklerini belirleyen temel unsurlardır. Bu bağların anlaşılması, kimya alanında yapılan araştırmaların ve uygulamaların temel taşlarını oluşturur. Ekstra Bilgiler: Kimyasal bağlar, aynı zamanda moleküler biyoloji, malzeme bilimi ve nanoteknoloji gibi alanlarda da önemli bir konu olarak incelenmektedir. Örneğin, nanoteknolojide, atom düzeyinde bağların kontrolü, yeni ve gelişmiş materyallerin tasarımı için kritik öneme sahiptir. |
.webp)








.webp)
.webp)









.webp)


.webp)
.webp)

.webp)










Kimyasal bağlar, atomların bir arada kalmasını sağlayan önemli kuvvetlerdir. İyonik ve kovalent bağlar arasındaki farklar oldukça ilginç. İyonik bağ, metal ve ametal atomları arasında gerçekleşir; burada metal atomu elektronunu kaybederken, ametal atomu bu elektronu alır. Sonuç olarak, pozitif yüklü katyonlar ve negatif yüklü anyonlar oluşturulur ve bu iyonlar arasındaki zıt çekim kuvveti, onları bir arada tutar. Öte yandan, kovalent bağ ise ametal atomları arasında gerçekleşir ve atomlar elektronları paylaşarak daha kararlı hale gelirler. Bu bağlar, apolar ve polar olmak üzere iki alt gruba ayrılır; apolar bağlarda elektronlar eşit şekilde paylaşılırken, polar bağlarda ise elektronlar eşit dağılmadığından kutuplaşma meydana gelir. Yani, iyonik bağlar tamamen elektron aktarımına dayalıyken, kovalent bağlar elektron paylaşımı ile oluşur. Bu farklılıklar, maddelerin fiziksel özelliklerini ve kimyasal reaktivitelerini etkileyerek, kimyasal bileşiklerin çeşitliliğine yol açar. Peki, bu bağların günlük hayattaki örnekleri nelerdir ve bu bağların hangi özellikleri, moleküllerin davranışlarını etkiler?
Kimyasal Bağların Önemi
Terim, kimyasal bağlar, günlük yaşamda birçok alanda karşımıza çıkan temel kavramlardır. İyonik ve kovalent bağlar arasındaki farkların anlaşılması, bu bağların özelliklerini ve etkilerini daha iyi kavramamıza yardımcı olur.
Günlük Hayattaki Örnekler
İyonik bağlara örnek olarak sofra tuzu (NaCl) verilebilir. Burada sodyum (Na) atomu bir elektron kaybederken, klor (Cl) atomu bu elektronu alır. Bu işlem sonucunda oluşan Na+ ve Cl- iyonları, zıt yükleri sayesinde bir arada tutulur. Kovalent bağ örneği olarak su (H2O) gösterilebilir; burada hidrojen ve oksijen atomları, elektronlarını paylaşarak stabil bir yapı oluştururlar.
Moleküllerin Davranışını Etkileyen Özellikler
Bağların özellikleri, moleküllerin fiziksel ve kimyasal davranışlarını etkiler. İyonik bileşikler genellikle yüksek erime ve kaynama noktalarına sahipken, kovalent bileşikler daha düşük erime noktalarına sahip olabilir. Ayrıca, iyonik bileşikler genellikle suda iyi çözünürken, apolar kovalent bileşikler su ile çözünmez. Kovalent bağların kutuplaşması, moleküllerin hangi ortamlarda çözüneceğini ve hangi kimyasal reaksiyonlara girebileceğini belirler. Bu nedenle, kimyasal bağların doğası, günlük yaşamda karşılaştığımız birçok madde ve bileşenin özelliklerini anlamamızda kritik bir rol oynamaktadır.
Kimyasal bağların atomları bir arada tutma gücü hakkında daha fazla bilgi verebilir misiniz? Özellikle iyonik ve kovalent bağların farklılıkları nelerdir?
Elbette Nil masal, kimyasal bağlar atomları bir arada tutan kuvvetlerdir ve iki ana türü vardır: iyonik ve kovalent bağlar. İyonik bağlar, bir atomun elektronu tamamen başka bir atoma vermesiyle oluşur. Bu durum, elektron veren atomun pozitif yüklü bir iyon (katyon) ve elektron alan atomun negatif yüklü bir iyon (anyon) olmasına neden olur. Bu zıt yüklü iyonlar arasındaki elektrostatik çekim, iyonik bağı oluşturur.
Kovalent bağlarda ise, atomlar elektronlarını paylaşır. Bu paylaşım, her iki atomun da kararlı bir elektron dizilimine ulaşmasını sağlar. Kovalent bağlar genellikle iki ametal atom arasında oluşur. İyonik bağlar genellikle sert ve kırılgan olup, yüksek erime ve kaynama noktalarına sahiptir. Kovalent bağlar ise genellikle daha düşük erime ve kaynama noktalarına sahiptir ve esneklik gösterebilir.
Bu farklar, bağların doğasındaki temel farklılıklardan kaynaklanır ve maddenin fiziksel ve kimyasal özelliklerini belirler. Umarım açıklayıcı olmuştur!