Elektron İlgisi Özellikleri ve Faydaları Nelerdir?
Elektron ilgisi, atomların bir elektron kazanma eğilimlerini ve bu sürecin enerji değişimini tanımlar. Kimyasal reaktivite, atom yapısı ve malzeme özellikleri üzerinde önemli etkilere sahiptir. Bu kavram, kimya, malzeme bilimi ve enerji üretimi gibi alanlarda kritik rol oynamaktadır.
Elektron ilgisi, atomların bir elektron kazanma eğilimlerini tanımlayan önemli bir kavramdır. Atomlar, dış elektron katmanlarındaki elektron sayısını artırmak için çeşitli koşullarda elektron çekebilirler. Bu süreç, atomların kimyasal reaktivitesinin ve yapısının anlaşılmasında kritik bir rol oynar. Aşağıda, elektron ilgisinin özellikleri ve sağladığı faydalar detaylandırılacaktır. Elektron İlgisi Nedir?Elektron ilgisi, bir atomun gaz halindeki durumunda bir elektron kazanması ile ortaya çıkan enerji değişimidir. Bu süreç, genellikle şu şekilde tanımlanabilir:
Elektron İlgisinin Özellikleri Elektron ilgisi, çeşitli özelliklere sahiptir. Bu özellikler, atomların kimyasal davranışlarını etkileyen temel faktörlerdir:
Elektron İlgisinin Faydaları Elektron ilgisi, çeşitli alanlarda önemli faydalar sağlamaktadır:
Sonuç Elektron ilgisi, atomların kimyasal reaktivitesini ve davranışlarını anlamak için kritik bir kavramdır. Atomların bir elektron kazanma eğilimleri, periyodik tabloda yer alan elementlerin özelliklerini ve malzemelerin davranışlarını etkiler. Kimya, malzeme bilimi ve enerji üretimi gibi birçok alanda önemli faydalar sağlayarak, bilimsel çalışmaların ve endüstriyel uygulamaların temel taşlarından biri haline gelmiştir. Elektron ilgisinin detaylı bir şekilde incelenmesi, gelecekteki araştırmalar ve teknolojik gelişmeler için büyük bir potansiyele sahiptir. |
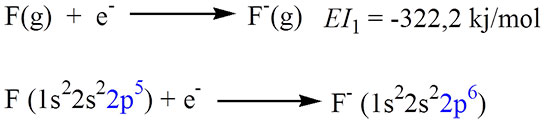
.webp)








.webp)
.webp)









.webp)


.webp)
.webp)

.webp)










Bir atoma elektron eklemek gercekten enerji mi gerektiriyor? Atom çapının küçülmesi neden elektron ilgisini artırıyor? Elektron ilgisinin deneysel olarak ölçülmesinin zor olduğunu söylemişsiniz, peki bu zorluk ne gibi faktörlerden kaynaklanıyor?
Berke deniz,
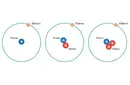
Elektron eklemek, atomun mevcut enerji seviyelerini etkilediği için gerçekten enerji gerektirir. Elektron ilgisi, bir atomun ek bir elektronu ne kadar kuvvetle çektiğini belirler ve bu süreç enerjinin salınması veya absorbe edilmesi ile sonuçlanabilir. Atom çapının küçülmesi, çekirdek ile dış elektronlar arasındaki elektrostatik çekim kuvvetinin artmasına neden olur. Bu da, atomun ek bir elektronu daha kuvvetli çekmesine ve dolayısıyla elektron ilgisinin artmasına yol açar.
Elektron ilgisini deneysel olarak ölçmenin zorluğu, bir dizi faktörden kaynaklanır. Öncelikle, eklenen elektronun enerji seviyesini hassas bir şekilde belirlemek gerekir ki bu oldukça karmaşık bir süreçtir. Ayrıca, atomun çevresel koşulları (sıcaklık, basınç, diğer atomlarla etkileşimler) ölçüm sonuçlarını etkileyebilir ve bu da deneylerin tekrarlanabilirliğini zorlaştırır. Bu nedenle, teorik hesaplamalar ve dolaylı ölçümler genellikle kullanılır.